Az emelt szintű kémiaérettségire felkészülni nem könnyű, hiszen számtalan tananyag tanulásával kell megküzdenünk. Az egyik ilyen a különböző kémiai kötések. Az anyagokat alkotó atomok nem önmagukban léteznek, hanem általában egy másik atommal alakítanak ki kölcsönhatásokat. Ezeket kémiai kötésnek nevezzük.
Az elsőrendű és a másodrendű kémiai kötések közötti különbség az, hogy az elsőrendűek esetében a kötési energia jóval nagyobb, mint a másodrendűek esetében. Az elsőrendű kémiai kötések egyike a kovalens kötés. Ehhez kapcsolódóan osztunk meg néhány hasznos információt cikkünkben.
A kémiaérettségire készülve
A kovalens kötés ismerete csak egy, a számtalan kémiaérettségi tananyagból, melyeket meg kell ismerned ahhoz, hogy a továbbtanuláshoz jó eredményt érj el a vizsgán. A felkészüléshez használhatsz feladatgyűjteményeket, könyveket, vagy segítséget kérhetsz más módon.
A Lvlmeup.hu kémia emelt szintű érettségi felkészítő tanfolyamokat tart online formában, melyek kiegészülnek konzultációkkal, így bármilyen kérdésed merül fel a tananyagokkal kapcsolatban, választ kaphatsz rá.
Tudnivalók a kovalens kötésről
Ismerjünk meg néhány fogalmat!
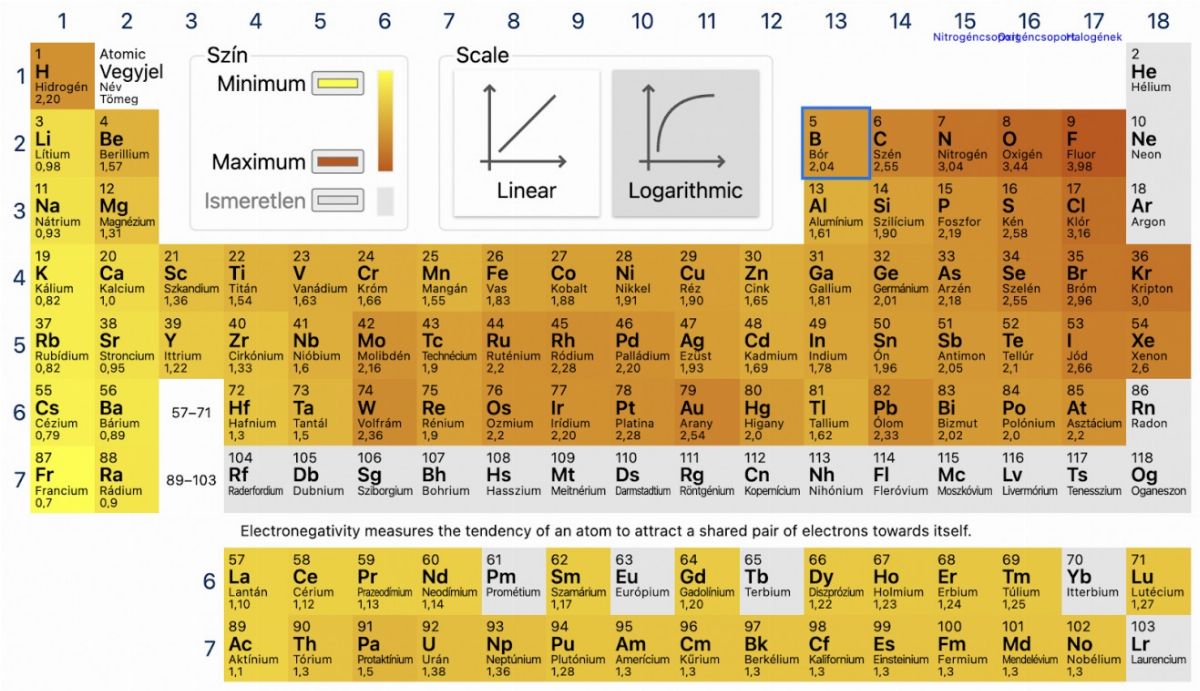
A kovalens kötésben nagy elektronegativitású atomok között alakul ki. Egy molekulapálya jön létre a két atompálya átfedésével. A kovalens kötés az, amikor két atom vegyértékelektronjai ezen a közös molekulapályán mozognak.
Az elektronegativitás fogalma arra utal, hogy a kovalens kötésben lévő atomok a molekulán belül vonzzák azt az elektronpárt, mely a kovalens kötést alkotja. Egyszerűbben fogalmazva ez az elektronvonzó képesség. Kovalens kötés általában a nemfémek esetében gyakori.
Fontos szabályként kell megjegyeznünk: a kovalens kötés két atom között akkor alakul ki, amikor az elektronegativitásbeli különbségük 1,7-nél kisebb.
Mikor alakul ki apoláris kötés?
Először is tisztáznunk kell, hogy mi az apoláris kötés. A poláris kötés esetében az egyik atomhoz mindig közelebb helyezkedik el a kötés, míg az apoláris esetében egyenlően oszlanak meg. Megállapíthatjuk, hogy a tisztán apoláris kötések főként azonos atomok között jöhetnek létre.
Azt is tudnunk kell, hogy nem feltétlenül kell az apoláris kötéshez tökéletesen azonosnak lennie a két atom elektronegativitásának, elég, ha közel azonosak. A szakirodalom szerint elég, ha ez az érték kisebb, mint 0,4: már akkor is apoláris a kötés.
A poláris kovalens kötés
A fentiek alapján már gondolhatjuk, hogy amennyiben az elektronegativitás értéke nagyobb, mint 0,4, akkor poláris a kovalens kötés. Ebben az esetben a kötést alkotó atomok nem egyformán vonzzák magukhoz az elektronpárt.
Ezek jelölésére az adott atom fölé írt görög delta betűt használjuk, értékét pedig plusz- vagy mínuszjellel határozzuk meg. Az egynél kisebb relatív töltést a deltával jelöljük. A nagyobb elektronegativitású atomhoz részleges negatív töltést, míg a kisebbhez pedig részleges pozitív töltést rendelhetünk.
Ha mindez számodra nem tűnik egyszerűnek, de ebből szeretnél érettségizni, keresd a Lvlmeup.hu kurzusait!














